肺炎支原体(Mycoplasma pneumoniae,MP)是已知能独立生存的最小微生物之一,介于细菌与病毒之间,属于单细胞生物,直径约为0.2-0.3μm,长度约0.5-1.0μm。缺乏细胞壁结构,因此对青霉素、头孢类抗生素天然耐药,也无固定形态,其形态可随环境的改变而不同,可因不同的生长阶段而有很大差异。MP的细胞由细胞膜、核糖体和双股DNA组成,无细胞核、细胞壁、鞭毛及芽胞。
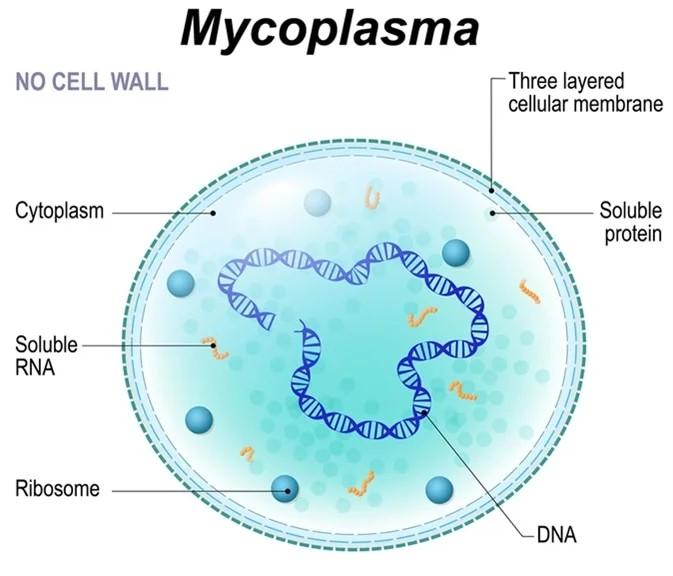
图1. 支原体结构示意图
传播机制
MP呈全球性分布,每2-6年引起一次全球暴发流行,人群普遍易感。MP肺炎以儿童和青壮年常见。MP易在人口密集或群居场所如学校、医院等易引起暴发流行。
MP是我国社区获得性肺炎首位致病源。通过特定的黏附机制侵袭呼吸道上皮细胞,引发一系列广泛的临床表现,从上呼吸道感染到严重的下呼吸道疾病——非典型肺炎,甚至涉及多种肺外并发症。MP仅寄生于人类,传染源是患者和携带者,借飞沫或气溶胶传播。潜伏期和治疗期均具有传染性,特别是病初4-6天传染性最强,所以家庭成员感染机会多。
致病机制
MP作为病原体进入肺泡后,会引发以肺泡巨噬细胞为主导方免疫细胞炎症反应。巨噬细胞通过释放细胞因子,促使中性粒细胞的迁移。肺泡中活化的中性粒细胞会释放白三烯、蛋白酶和ROS,从而加重组织损伤和肺泡水肿。而MP与支气管细胞的黏附可通过产生H2O2等氧化物引发氧化应激,从而加重细胞损伤及死亡,最终引起支气管炎。
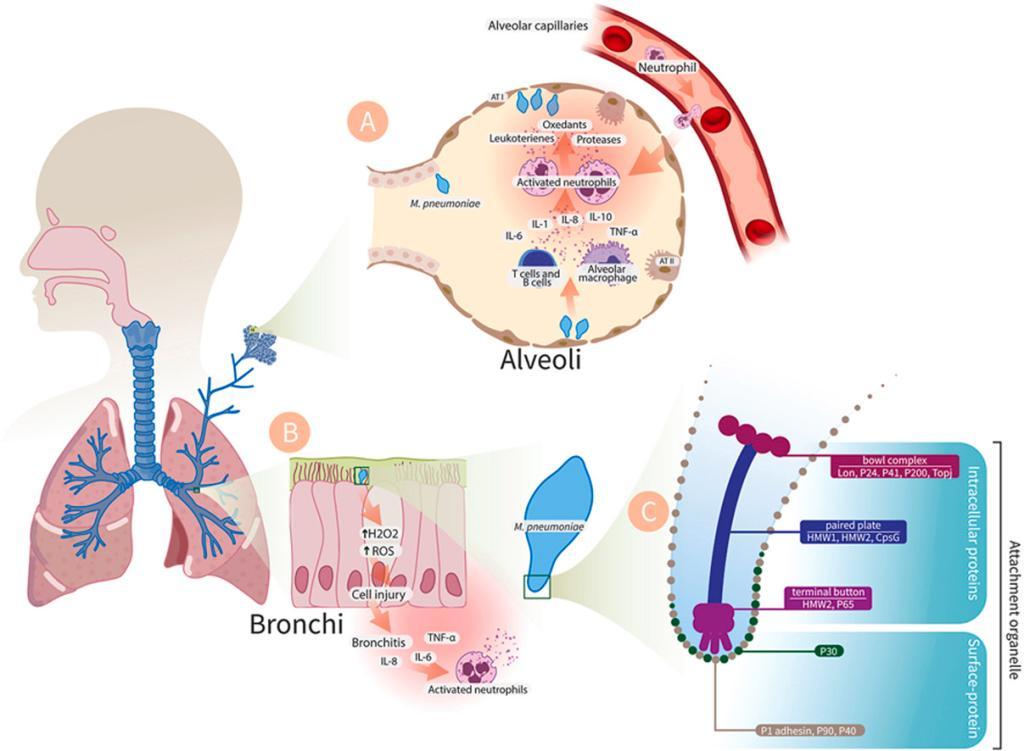
图2. 肺炎支原体发病机制
(Microb Pathog. 2024 Nov:196:106944.)
MP的致病性主要依赖于其黏附能力,主要粘附蛋白及致病因子包括以下几种:
P1蛋白:是主要的黏附蛋白之一,相对分子量为170 kDa,由1627个氨基酸组成,位于黏附细胞器的顶端。P1蛋白在与宿主细胞受体结合、黏附以及滑行运动中发挥重要作用。它还参与释放CARDS毒素、过氧化氢和超氧自由基,从而损伤宿主细胞。
P30蛋白:大小为30 kDa,位于黏附细胞器的尖端,是一种膜结合蛋白。P30蛋白具有细胞黏附、滑行运动和稳定P65蛋白的功能。
HMW蛋白:包括HMW1、HMW2、HMW3,是一组高分子量复合蛋白,参与细胞黏附,有助于黏附细胞器的结构,包括主要黏附蛋白P1的定位。
P65蛋白:是黏附细胞器内部核心结构的一部分,与细胞黏附和滑行运动相关。
CARDS毒素:是一种社区获得性呼吸窘迫综合征毒素,由P1蛋白参与释放,能够损伤宿主细胞。
P90、P40与P65蛋白:P90与P40作用是将P1蛋白锚定在黏附细胞器的细胞骨架中, 并使聚集在黏附细胞器中的P1蛋白能稳定发挥其黏附功能。P65主要是作为其他黏附辅助蛋白的作用靶位。
这些蛋白共同作用,使肺炎支原体能够黏附于宿主细胞表面,逃避宿主的免疫清除机制,并在呼吸道内定植和引发感染。
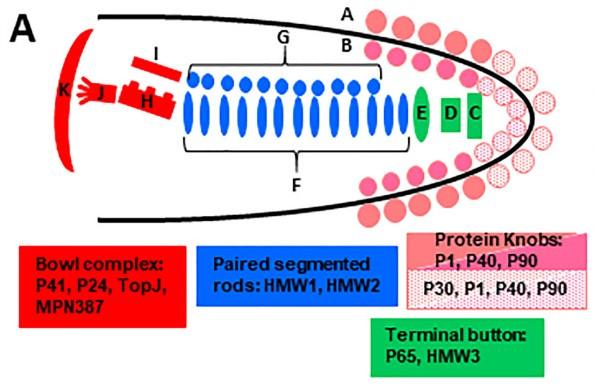
图3. 肺炎支原体末端细胞器结构示意图
(Mol Microbiol. 2018 May;108(3):306-318.)
7月,中国医学科学院北京协和医学院在“International Journal of Molecular Sciences”发表了题为“An mRNA Vaccine Targeting the C-Terminal Region of P1 Protein Induces an Immune Response and Protects Against Mycoplasma pneumoniae”,该文使用了AntibodySystem的Recombinant Mycoplasma pneumoniae mgpA/Adhesin P1 Protein, N-His(货号YXX09301)来评估疫苗诱导的体液免疫应答强度,将该蛋白作为包被抗原,通过ELISA检测接种mRNA-SP+P1疫苗的小鼠血清中特异性抗P1 IgG抗体水平。结果证实该疫苗能有效激发高水平抗体(三剂后滴度达10?–10?),且这些抗体具有功能性——免疫血清显著抑制了肺炎支原体对宿主细胞的吸附能力。
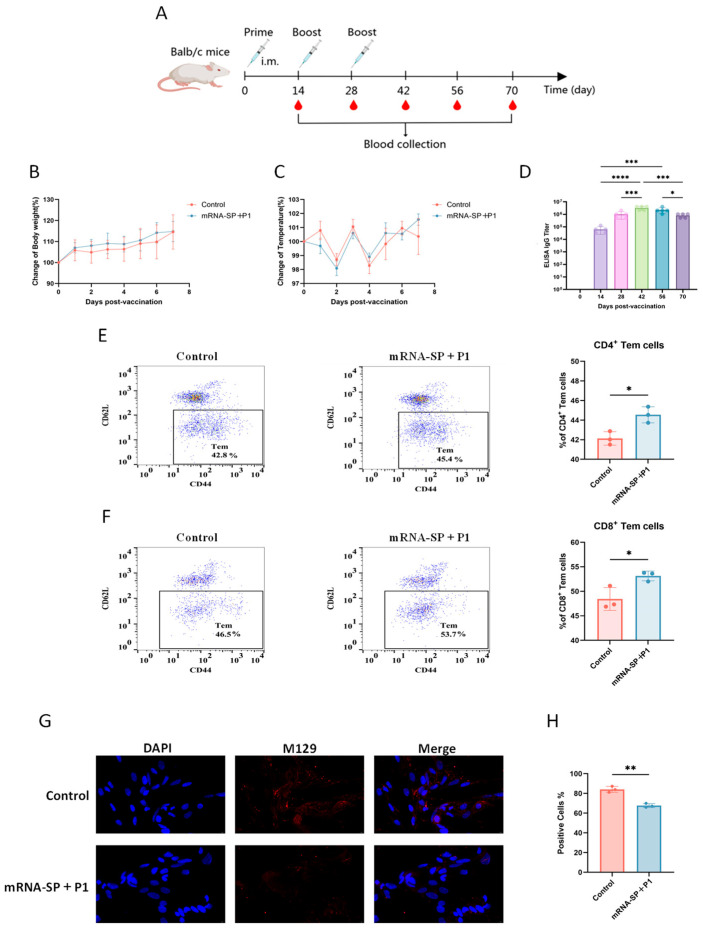
图4. mRNA-SP+P1疫苗激活小鼠的体液和效应记忆T细胞反应
(Int J Mol Sci. 2025 Jul 7;26(13):6536.)
AntibodySystem精心开发了一系列针对肺炎支原体(Mycoplasma pneumoniae,MP)的优质重组蛋白和抗体产品,这些产品具有高纯度、高特异性和高灵敏度,能够满足科研人员在基础研究、诊断试剂开发以及药物研发等多方面的需求,助力科研人员深入探究MP的感染机制、致病过程以及临床应用。
重组蛋白
|
货号 |
产品名称 |
|
YXX09301 |
Recombinant Mycoplasma pneumoniae mgpA/Adhesin P1 Protein, N-His |
|
YXX16801 |
Recombinant Mycoplasma pneumoniae CARDS Protein, N-His |
|
YXX17401 |
Recombinant Mycoplasma pneumoniae P30 adhesin Protein, N-His |
|
YXX16601 |
Recombinant Mycoplasma pneumoniae 116 kDa surface antigen Protein, N-His |
|
YXX16701 |
Recombinant Mycoplasma pneumoniae HMW3 Protein, N-His-SUMO |
|
YXX16901 |
Recombinant Mycoplasma pneumoniae p65 Protein, N-His |
|
YXX09302 |
Recombinant Mycoplasma pneumoniae mgpA/Adhesin P1 Protein, N-His |
|
YXX17301 |
Recombinant Mycoplasma pneumoniae MP438/MPN400 Protein, N-His |
|
YXX09303 |
Recombinant Mycoplasma pneumoniae mgpA/Adhesin P1 Protein, N-His |
|
YXX17501 |
Recombinant Mycoplasma pneumoniae Mgp3/P90 Protein, N-His |
抗体
|
货号 |
产品名称 |
|
PXX09301 |
Anti-Mycoplasma pneumoniae mgpA/Adhesin P1 Polyclonal Antibody |
|
PXX16801 |
Anti-Mycoplasma pneumoniae CARDS Polyclonal Antibody |
|
PXX17401 |
Anti-Mycoplasma pneumoniae P30 adhesin Polyclonal Antibody |
参考文献
1. Georgakopoulou V, Ioannis Lempesis, Pagona Sklapani, Trakas N, Demetrios Spandidos. Exploring the pathogenetic mechanisms of Mycoplasma pneumoniae (Review). Experimental and Therapeutic Medicine. 2024;28(1).
2. Hu J, Ye Y, Chen X, Xiong L, Xie W, Liu P. Insight into the Pathogenic Mechanism of Mycoplasma pneumoniae. Current Microbiology. 2022;80(1).
3. Hamed Tahmasebi, Babaeizad A, Mohammadlou M, Farnaz Alibabaei, Seyedeh Zahra Banihashemian, Eslami M. Reemergence of Mycoplasma pneumoniae disease: pathogenesis and new approaches. Microbial Pathogenesis. 2024;196:106944-106944.
4. Jiang Z, Li S, Zhu C, Zhou R, Leung PHM. Mycoplasma pneumoniae Infections: Pathogenesis and Vaccine Development. Pathogens. 2021;10(2):119.
5. Krause DC, Chen S, Shi J, Jensen AJ, Sheppard ES, Jensen GJ. Electron cryotomography of Mycoplasma pneumoniae mutants correlates terminal organelle architectural features and function. Molecular microbiology. 2018;108(3):306-318.
6. Zhang F, Li C, Wu Y, et al. An mRNA Vaccine Targeting the C-Terminal Region of P1 Protein Induces an Immune Response and Protects Against Mycoplasma pneumoniae. International Journal of Molecular Sciences. 2025;26(13):6536-6536.