蛋白质免疫印迹(Western blot,WB)是一种常规但是强大的蛋白检测方法,可用于研究翻译后修饰蛋白相对丰度、相对质量以及研究蛋白质-蛋白质相互作用,从诞生以来为学术研究、诊断和治疗测试提供了有价值的参考。如图1所示,WB通过凝胶电泳分离天然或变性蛋白质,转移到膜上并可以保持多肽类型和生物学活性不变,用特异性抗体识别和定量从细胞或组织裂解液中提取的复杂混合物中的特定蛋白质。
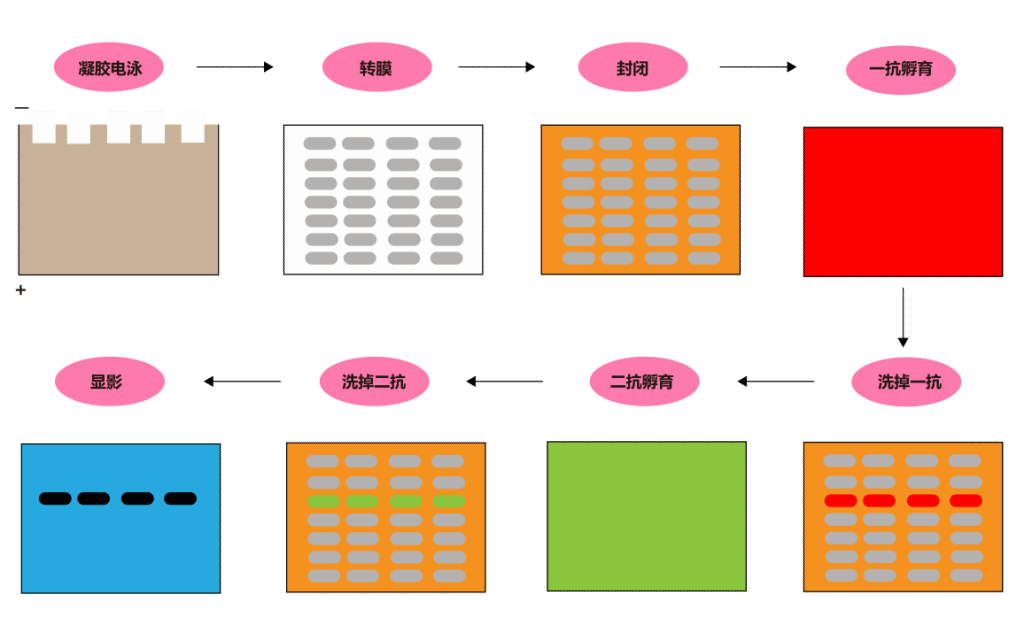
图1. WB实验流程
本文以常见市售快速蛋白凝胶试剂盒为例,就快速WB从制胶到最后显影的实验流程进行梳理。
实验所需试剂
1) 蛋白上样缓冲液(市售缓冲液大多为5x、4x等,严格按照说明书稀释)
2) 快速蛋白凝胶(新手建议使用彩色凝胶,清晰泳道,方便上样,实物可参考图4)
3) 蛋白Marker(根据目的蛋白大小选取合适的蛋白Marker)
4) 电泳缓冲液(可自配,也可买商品化的粉末或溶液)
5) 考马斯亮蓝染色液(倾情推荐小佰家X-Stain SDS-PAGE 极速染色液 (货号BLBP00015))
6) 转膜液(可自配,也可买商品化的粉末或溶液,请注意,部分商品化转膜液仍需自行加入一定比例甲醇溶液)
7) 5%脱脂奶粉(使用TBST配置)
8) ECL发光液(根据靶蛋白丰度、蛋白样品量等选择合适灵敏度的ECL试剂盒)
WB实验流程
一、制胶
1) 洗净玻璃板,用自来水冲洗干净,再用蒸馏水或者超纯水冲洗后晾干待用(如急用,可使用吹风机吹干或放置于烘箱烘干使用);
2) 选择合适厚度胶对应的玻璃板(0.75mm、1.0mm、1.5mm),一般蛋白表达丰度低,需大量上样时,且上样孔较多时,选择厚胶,反之亦然,胶越薄转膜越快,但是太薄容易破;
3) 对齐玻璃板,放入制胶架中卡紧,为了防止漏胶,玻璃板底部一定要平,可以在灌胶之前加适量超纯水检漏,然后垂直卡在架子上;
4) 配胶可以使用15 mL或50 mL离心管配制,分离胶A液B液等体积混匀;浓缩胶A液和B液1:1混匀;
5) 分离胶加入APS(1ml胶加入10μl,APS用量可根据室温调整,温度较高时降低用量,反之亦然),混匀,灌入玻璃板;
6) 浓缩胶加入APS(1ml胶加入10μl),混匀,灌入玻璃板;分离胶灌完之后也可加水液封,10min分离胶聚合再灌浓缩胶,插入梳子,室温放置30min即可聚合;

图2. 蛋白凝胶电泳垂直电泳设备
二、电泳
聚丙烯酰胺凝胶电泳通过电场力分离不同分子量的蛋白质。
如图3所示,当施加电压时,由于浓缩胶的浓度低、孔径大,分离胶的浓度高、孔径小,带电蛋白质在浓缩胶运动时阻力小、速度快,当接近分离胶时,阻力变大、速度减慢,此时样品开始浓缩,形成窄带;
当蛋白分子进入分离胶的时候,由于分子筛的作用,小分子物质容易通过,阻力小,迁移速度快,大分子物质滞后,因此会根据分子量大小的不同从凝胶中分离出来。
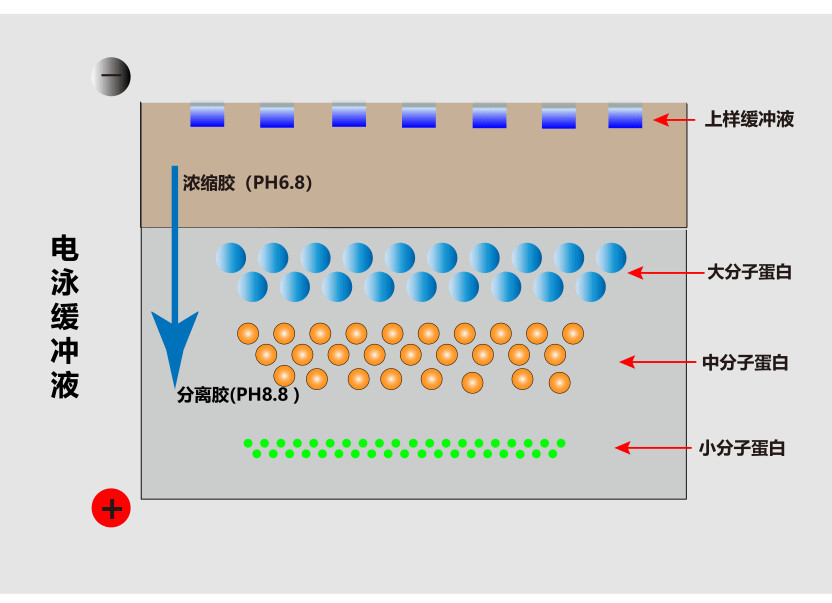
图3. 凝胶电泳示意图
1、组装电泳槽
玻璃板按照高的玻璃板在电泳槽外侧,低的玻璃板在内侧方向,夹紧玻璃板贴紧电泳槽胶片,防止漏液,倒入配制好的1×电泳液(常用电泳液为Tris-Gly),内槽加满,外槽没过导线,然后缓慢拔出梳子,形成梳孔,可以用移液枪吸取电泳液冲洗梳孔,此时因为拔出梳子内槽电泳液液面会下降,应补满内槽电泳液(至少漫过内侧的小玻璃板),外槽电泳液可重复使用2-3次。

图4. 组装后电泳仪主体
2、加样
1) 提前取出蛋白样本,如冻存时间过长(最好用新鲜蛋白),自然解冻,水浴锅100℃变性3-5min,后离心;
2) 根据前期所测蛋白浓度计算每个样本的上样体积(亦可用上样缓冲液调整浓度统一体积),通常上样总蛋白质量为20-30μg(可根据目的蛋白表达丰度调节),蛋白Marker加3μl即可,便于对照蛋白条带;
3) 上样时间尽可能短,避免样本扩散,也不能过快避免样本溢出造成相邻孔交叉污染,同时为避免条带不齐,两边空的孔应该对称或用加入等量的上样缓冲液;
3、调节电泳参数
1) 电泳槽和盖以及电源插孔的红色为正极,黑色为负极,避免插反;
2) 电泳参数可设置为80V,20min,120V,90min(电泳参数可参考制胶试剂盒说明书,也可根据实际情况进行调整),电泳在冰浴下进行。

图5. 彩色凝胶电泳
4、考马斯亮蓝染色(X-Stain SDS-PAGE 极速染色液 ,货号BLBP00015,非必须步骤)
1) 电泳后,将凝胶置于清水中漂洗两次;
2) 将凝胶置于一洁净的玻璃或塑料容器中,加入适量染色液,用量以可覆盖凝胶为准;
3) 置于摇床上摇动显色,2-3min后可看到条带, 条带随时间的延长会加深。 一般染色5min后根据蛋白染色条带结果,决定下一步实验。
4) 染色结束后,回收染色液,将凝胶置于水中,即可观察结果。染液可重复利用 2-3次, 使用次数越多,染色需要的时间越长,但灵敏度不受影响。
三、转膜
因为蛋白条带在凝胶中容易扩撒,凝胶也易碎,而且后期抗体也很难进入凝胶中与蛋白特异性结合,因此需要将凝胶中的蛋白转移至一种固相载体(NC膜、PVDF膜等)上面,以便于后期的封闭、抗体孵育、显色等步骤,目前常用的转膜方式是湿转和半干转,本次主要介绍的湿转:
1) 因为蛋白在凝胶中时间过久容易扩散,所以电泳结束前10-15min,应做好转膜准备工作;
2) 准备工作:4℃预冷转膜液,按照凝胶大小切割好滤纸和膜(滤纸≥膜≥胶),如PVDF膜应用100%甲醇浸泡活化30-60s,NC膜和滤纸可置于转膜液浸泡平衡;
3) 小心分离玻璃板,用切胶板切掉浓缩胶及多余分离胶。
4) 整个过程在一个充满转膜液的托盘中进行,各部分由负极到正极的顺序是夹板-海绵-滤纸-胶-膜-滤纸-海绵-夹板(三明治结构,图5),注意赶走各层之间的气泡,整个过程戴手套用平头镊子进行,不能用手指触碰到膜和胶。
5) 三明治结构夹紧放入电转槽,灌满转膜液,确认好电极的颜色盖上盖子,冰浴,设置300mA,85V,转膜2h即可完成转膜。
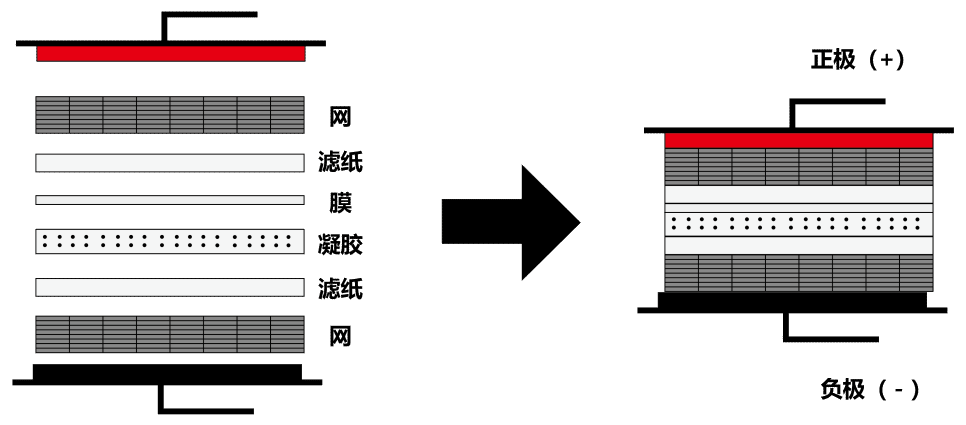
图6. WB湿转三明治各组分位置
四、封闭
为了避免抗体与膜的非特异性结合,造成高背景,因此需要对膜上的非目的蛋白结合位点进行封闭处理。提前配制好封闭液,封闭液应该封闭所有未结合位点而不替代靶蛋白,不结合靶蛋白表位,也不与抗体或者检测试剂发生交叉反应,一般常用的封闭液有脱脂牛奶、牛血清白蛋白(BSA)、全血清、鱼胶等。
1) 以5%脱脂牛奶为例,脱脂牛奶需要完全溶解,一般用TBST稀释;
2) 对照Marker找到目标蛋白分子量剪下对应条带(有些杂志要求整膜印记,可不剪);
3) 摇床室温封闭1-2h。
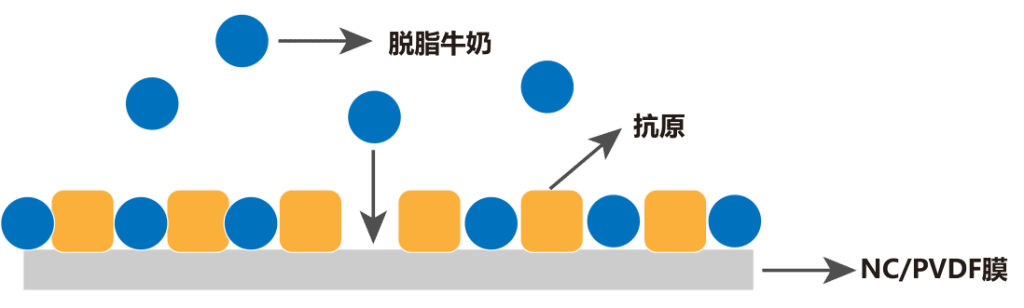
图7. 封闭原理
五、抗体孵育
抗体孵育分为两步,分别是一抗和二抗,一抗能与目的蛋白结合,二抗是被标记了的抗体,一个一抗可以和多个二抗结合,从而起到放大信号的作用,提高检测的灵敏度。有些抗体是直标抗体,即一抗直接偶联标记物,无需二抗,大大节约实验时间。

图8. 抗体说明书相关信息
选择抗体的时候应注意抗体种属:根据一抗的物种来源选择相应的抗该物种的二抗,例如,如果你的一抗是小鼠源的单克隆抗体,二抗则选抗小鼠的二抗(山羊抗小鼠,兔抗小鼠等),一抗来源参考抗体说明书。
1) 封闭后要进行一抗的孵育,根据经验、目标蛋白表达丰度、上样量、说明书等确定稀释比例。一般用封闭液稀释,封闭结束后立即加入一抗,室温在摇床孵育1-2h,或者4摄氏度摇床孵育过夜;
2) 一抗孵育结束后,用TBST洗涤3次,每次10min(如果之前做过结果背景较高,可延长洗涤时间和增加洗涤次数,二抗同理)。按照相应比例稀释二抗,加入二抗,室温摇床孵育1-2h后TBST洗涤3次,每次10min。
六、显影
常见的WB显色的方法主要有:放射自显影、化学底物发光ECL显色、底物DAB显色、荧光显色(无需发光液)。因为ECL化学发光成灵敏度高且容易检测,是多数实验室的首选检测方法,检测原理是二抗偶联的是辣根过氧化物酶(HRP)或者碱性磷酸酶(AP),可以催化H2O2与鲁米诺反应发光,从而被胶片或者数字成像系统检测到。
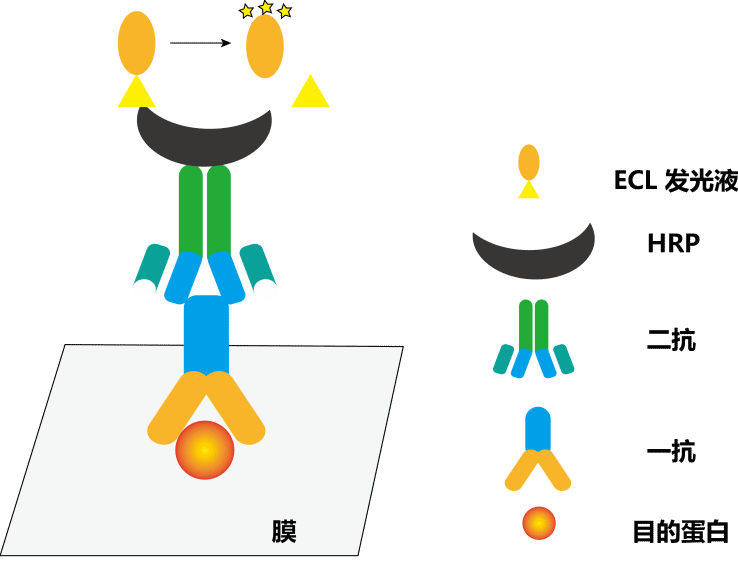
图9. 抗体孵育显影原理
1) 将ECL发光液A液B液按照1:1的比例混匀,现配现用;
2) 将洗好的膜取出,沥干TBST缓冲液,但不可让膜干燥;
3) 滴加发光液,孵育1-2min;
4) 移到暗室或者使用成像系统曝光获取信号,可根据显影效果适当调整曝光时间以获得最佳结果。
5) 显影结束后,如需检测其他蛋白质,可通过膜再生液洗脱之前的抗体,重新孵育其他抗体,步骤同上(可通过再次显影判断抗体是否被完全洗脱)。
下期更新WB实验中的常见问题,您在WB实验中遇到过哪些“玄学”时刻?欢迎留言分享~