癌症免疫疗法已成为肿瘤治疗的基石。在这种方法中,T细胞是疗效的主要介质。这些特殊的免疫细胞亚群能够特异性识别肿瘤细胞,并在适当激活后进行消除。肿瘤微环境(TME)中决定活化的T细胞命运的潜在生物过程的开发是癌症免疫疗法的一个主要研究方向。通过使用PD-1/PD-L1和/或CTLA-4阻断剂靶向免疫抑制信号(免疫检查点)来实现免疫应答,已经显示出针对大量恶性肿瘤的显著临床疗效,但是仅局限于一小部分患者。关卡阻断与T细胞抑制阻断平行,通过作用于共刺激受体如CD137、OX40、TNFR2、CD27、CD40或GITR的激动剂对免疫细胞的刺激构成了非常活跃的临床前和临床研究领域。
CD137生物学背景
CD137/4-1BB(tnfrsf9)是一种共刺激受体,属于肿瘤坏死因子受体超家族(TNFRSF)的成员之一。CD137在抗原暴露后迅速在CD4+和CD8+T细胞上表达, CD137和激活T细胞上的T细胞受体(TCR)能向T细胞传递共刺激信号,从而导致T细胞增殖、存活,记忆形成和更强的细胞毒性和细胞因子产生的效应器功能。
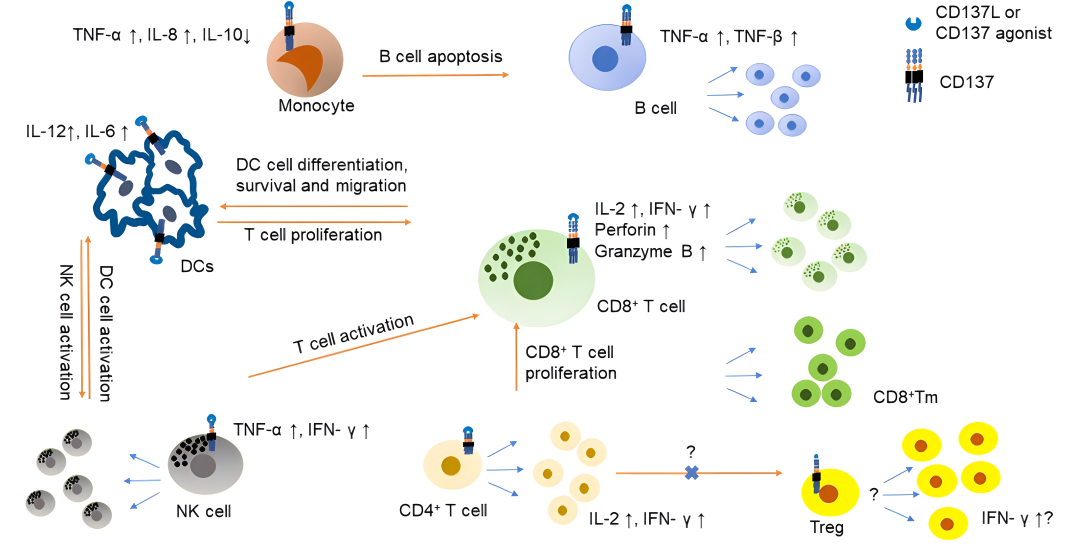
CD137在肿瘤微环境中对免疫细胞的作用
尽管 CD137 的细胞内结构域缺乏酶活性,但它通过募集 TRAF1、TRAF2 和可能的 TRAF3 等蛋白质来发挥其功能。这些蛋白质促进 CD137 信号转导的传递,启动细胞内通路(如 NF-κB 和 MAPK)的激活。这种活化序列导致细胞活化、增殖和存活。
CD137具有抗凋亡的作用。研究发现,CD137诱导Bcl-XL和抑制BIM的表达,从而减少细胞死亡。这个机制可能有助于干预活化诱导的细胞死亡。在T细胞上,CD137的表达受到T细胞受体(TCR)刺激和CD3信号的调控。此外,CD28共刺激可以增强CD137的表面表达。CD137在T细胞中产生强烈的共刺激信号,与TCR信号协同作用产生白细胞介素(IL)-2和干扰素? (IFN-?)等细胞因子。此外,CD137共刺激还有助于T细胞的记忆形成和效应细胞分化,保护T细胞免于凋亡,并改变线粒体代谢,增加细胞的呼吸能力。此外,CD137还可以诱导整体DNA去甲基化和染色质重编程。
在肿瘤模型中的研究表明,CD137在CD8+ T细胞中发挥重要作用。CD137在CD8+ T细胞上的表达可以增加细胞的活化和增殖,增强细胞对肿瘤特异性抗原的识别和杀伤能力。此外,CD137也可以在CD4+ T细胞上诱导共刺激效应,包括CD4+FoxP3+调节性T细胞。同时,CD137的触发可以增加NK细胞的活化水平,进一步增强其对肿瘤细胞的杀伤能力。
由于CD137在增强细胞免疫及抗肿瘤免疫治疗中的潜力,它成为了一个引人注目的靶点。这些发现为癌症免疫治疗和免疫调节疾病的治疗提供了新的思路和策略。
CD137的癌症免疫治疗临床进展
CD137激动剂作为一种免疫治疗药物,在肿瘤模型中显示出良好的抗肿瘤活性。与其他抗肿瘤治疗药物的联合应用,如检查点抑制剂和免疫刺激性单克隆抗体,可以进一步增强其疗效。此外,与放射疗法、基因治疗或细胞免疫治疗的组合也显示出潜在的协同效应。
CD137激动剂作为一种免疫疗法药物已经在临床中进行了评估。目前有两种方法来利用CD137,一种是通过抗CD137靶向单克隆抗体或双特异性抗体进行治疗,另一种是通过细胞质CD137结构域形成CAR-T细胞的一部分。
针对CD137的CAR-T细胞疗法已经被FDA批准用于治疗B细胞儿童白血病和难治性B细胞淋巴瘤。与CD28结构域的CAR相比,基于CD137的CAR具有更好的过继T细胞持久性,并且与代谢适应性和表观遗传重编程等有益特性相关。
在临床环境中已经测试了两种CD137激动剂抗体:urelumab和utolimumab。Urelumab是一种完全基于人IgG4的抗体,但由于严重的肝脏炎症副作用,其单一疗法的试验被迫终止。降低剂量后,urelumab的安全性改善,但治疗效果有所降低。与抗PD1抗体nivolumab联合应用的低剂量urelumab在转移性黑色素瘤中显示出有希望的临床反应。
Utolimumab作为一种较弱的CD137激动剂,作为单独的疗法几乎没有临床效果。但与利妥昔单抗和乌雷单抗的联合治疗显示出良好的耐受性、安全性和初步的临床活性。CD137单克隆抗体疗法旨在刺激TME内的肿瘤特异性T细胞活性。然而,肿瘤对单克隆抗体治疗的敏感性可能取决于肿瘤内已有的T细胞浸润和CD137的表达水平。因此,在临床实践中,寻找预后和预测标志物仍然是一个重要的研究领域。
CD137激动剂作为免疫疗法药物在临床中已经显示出一定的活性和安全性。但仍需要进一步的研究来确定最佳的治疗策略和寻找相关的预后标志物。这将有助于更好地利用CD137激动剂的潜力,为患者提供更好的癌症治疗选择。
临床前研究显示,与CD137激动剂相关的肝毒性可以通过激活CD8+ T细胞和IFN-?的分泌来介导。进一步的研究表明,CD137单克隆抗体与肝脏内的单核细胞和库普弗细胞相互作用,导致肝脏炎症和CD8+ T细胞的活化。为了在肿瘤组织微环境中特异性地引入CD137激动剂,研究人员已经开发了不同的方法。
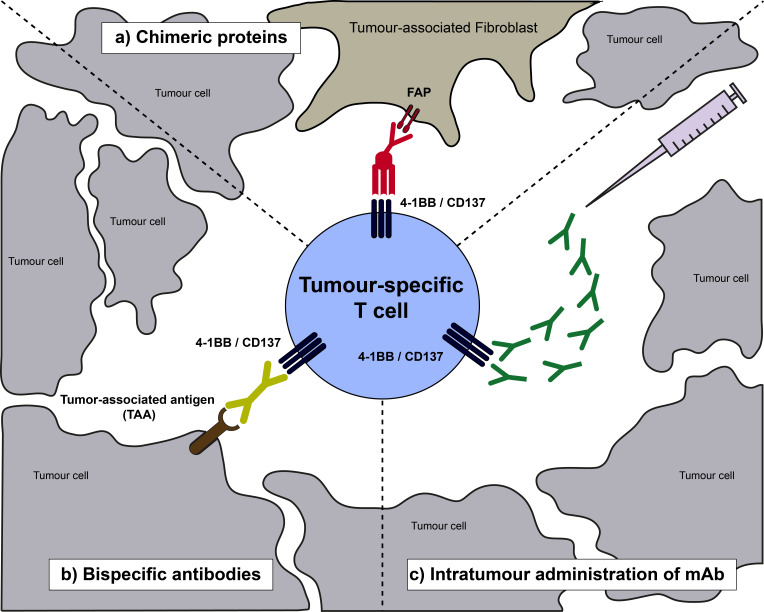
肿瘤抗原识别引发的肿瘤浸润性T淋巴细胞表达CD137示意图
其中先进的方法之一是基于CD137的双特异性构建体。例如,一种靶向T细胞上的CD137和肿瘤细胞上表达的HER2的双特异性抗体已经在临床中进行了测试,并显示出良好的耐受性和临床活性。另一种正在临床中开发的构建体是靶向PD-L1和CD137的双特异性抗体。
在临床前研究中,靶向肿瘤抗原5T4和CD137的双特异性抗体显示出抗肿瘤活性。此外,一种以成纤维细胞活化蛋白(FAP)为基础,结合CD137L三聚体的嵌合蛋白也展示了强大的抗肿瘤活性,并且在动物模型中没有毒性迹象。为了避免CD137激动剂引发的肝毒性,一些研究采用缺乏Fc区域的CD137构建体,这种设计既保持了足够的激动活性又减少了肝毒性。
另一种向肿瘤微环境提供CD137共刺激的方法是直接将低剂量的CD137单克隆抗体注射到肿瘤灶中。目前正在进行的临床试验中,研究人员将低剂量的CD137单克隆抗体与全身注射的nivolumab联合应用于实体瘤患者。
CD137激动剂的肝毒性是一个重大挑战。为了将CD137共刺激特异性地传递到肿瘤组织,研究人员开发了各种策略,包括基于CD137的双特异性构建体和直接瘤内注射单克隆抗体。这些方法在临床前和临床环境中显示出良好的活性和耐受性,为CD137激动剂的开发开辟了新的途径。因此,正在进行的研究对于完善治疗策略和减轻与CD137激动剂治疗相关的副作用至关重要。
法国AntibodySystem开发出一系列针对CD137相关蛋白及抗体产品。想了解更多相关蛋白抗体科研试剂,可扫描下方二维码或直接联系我们的产品专员进行咨询,咨询热线027-65279366。

参考文献:
[1] I?aki Etxeberria,Javier Glez-Vaz,et.al.New emerging targets in cancer immunotherapy: CD137/4-1BB costimulatory axis.ESMO Open. 2020 Jul;4(Suppl 3):e000733.
[2] CD137 as anAttractive T Cell Co-Stimulatory Target in the TNFRSF for lmmuno-Oncology DrugDevelopment. Cancers 2021,13,2288.
