20世纪90年代末期,抗体技术在肿瘤领域广泛应用,尤其是针对恶性肿瘤细胞特异性抗体的应用。免疫疗法在癌症中取得了突破性进展,相较传统化疗和靶向治疗,免疫治疗可通过激活患者免疫系统来识别和对抗肿瘤细胞。双特异性抗体能够招募免疫细胞参与随后杀死肿瘤细胞,被广泛应用于肿瘤的免疫治疗。
表 抗肿瘤双特异性纳米抗体Anti-tumorbispecificnanobodies
|
抗体名称
|
靶标
|
治疗疾病
|
|
IE2-AIb8/6E10-AIb8
|
HGF/HSA
|
HGF表达肿瘤,如胶质瘤
|
|
MaAbNA
|
HER2/EGFR1
|
乳腺癌
|
ttαGFP-αCEA
ttαGFP-αEGFR-αCEA
|
CEA/GFP/EGFR
|
人表皮样癌
|
|
VHHEGFR-VHHGFP
|
GFP/EGFR
|
EGFR阳性肿瘤
|
|
VHHCD3ε-VHHCD19
|
CD3ε/CD19
|
特异性表达CD19的肿瘤
|
|
7D12-5GS-6H4
|
Vγ9Vδ2-Tcells/EGFR
|
Vγ9Vδ2-Tcells的肿瘤
EGFR相关肿瘤
|
|
ENb-TRAIL
|
DR/EGFR
|
大肠癌、肺癌和胶质瘤
|
|
RR2-H-RR4-Lip
|
HER2表位1/HER2表位2
|
乳腺癌
|
|
Muc1-Bi-1
|
Muc1/CD16
|
Muc1细胞异常表达引发的多种癌症
|
|
NanoCAR
|
HER2/CD20
|
B细胞白血病和淋巴瘤
|
|
PEG-S-Fab
|
CEA/CD3
|
人结肠腺癌细胞治疗
|
|
SBC77
|
CEA/CD16a
|
CEA在不同恶性肿瘤中过度表达的治疗
(包括结肠直肠癌、胃癌、乳腺癌等)
|
|
STAR-isolatedNb157
|
CD13/TIM3
|
急性髓系白血病
|
|
Bi1/Bi2
|
FP/EGFR
|
肺癌、头颈癌和结肠癌等高表达EGFR的恶性肿瘤
|
|
TSsdAb
|
CD16/EGFR
|
EGFR阳性肿瘤
|
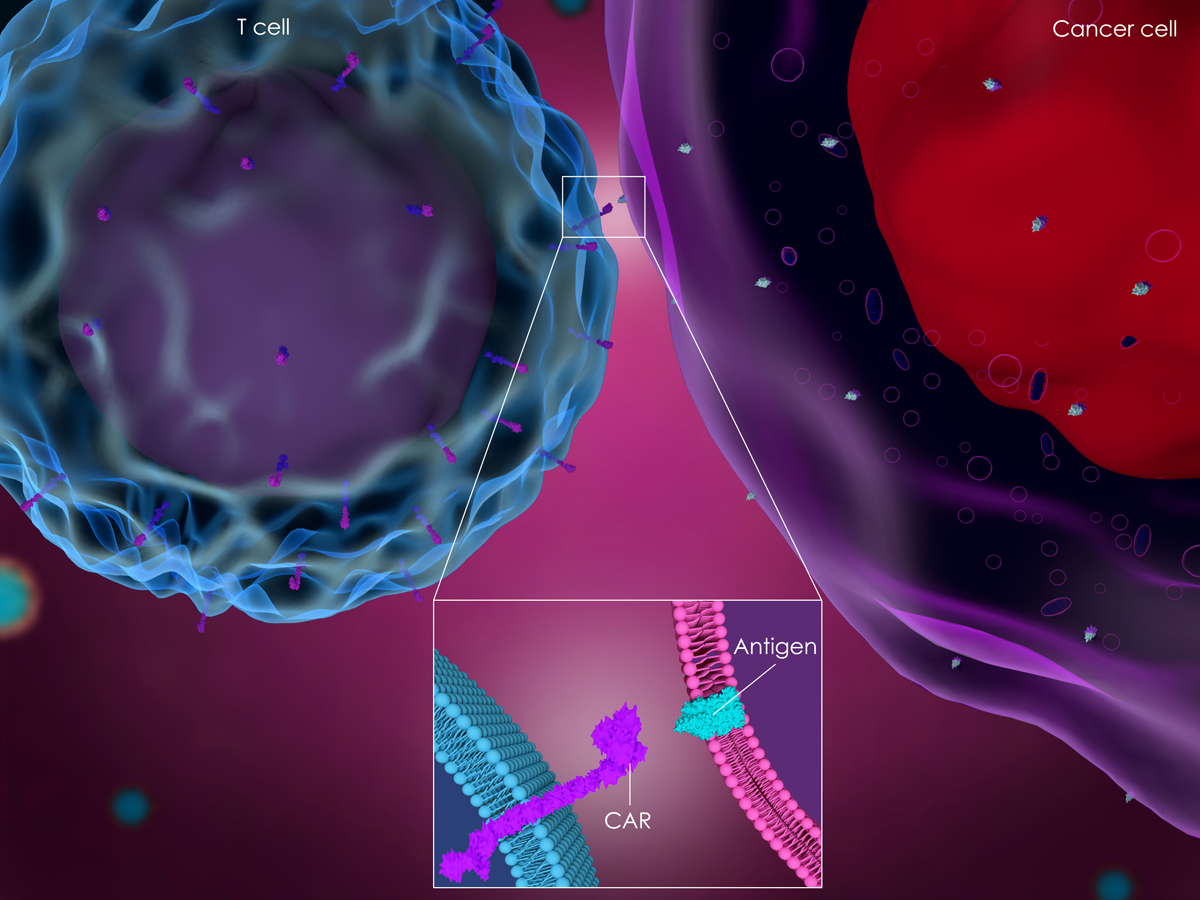
CAR-T细胞
CAR-T细胞(chimeric antigen receptors-modified T cells)疗法是一种通过基因修饰使T细胞表达肿瘤特异性嵌合抗原受体的一种新型肿瘤免疫疗法。CAR结构通常由抗体单链可变片段scFv与细胞内信号转导结构域连接而成,经CAR修饰后的T细胞能够识别肿瘤细胞的特异性抗原,并起到杀伤肿瘤细胞的作用。但单链抗体在CARs中表现出一定程度的寡聚化,导致强直信号转导、T细胞衰竭和体内表现不佳。此外,CAR-T细胞治疗虽对B细胞恶性肿瘤具有显著的临床疗效,但针对其他实体肿瘤和抗原的疗效仍有不足。因此,为克服目前CAR-T细胞治疗的困难与局限,研究者们致力寻找能够替代单链抗体的其他抗原结合域,其中纳米抗体和双特异性纳米抗体是较为理想的选择。
目前,以纳米抗体作为CAR细胞外抗原识别结构域的研究主要靶向CD19、CD20、CD30和CD22,其中以CD19和CD3组合的研究最为广泛。CD20是一类重要的B细胞表达分化的抗原,在Ca2+通道中参与调控细胞周期进程。CD47在肿瘤细胞免疫抵抗和逃逸中起重要作用。CD22是一种唾液酸结合性免疫球蛋白,赵振东等构建靶向CD22的嵌合抗原受体,弥补了scFv在分子量、分子表达和功能发挥上的缺陷。
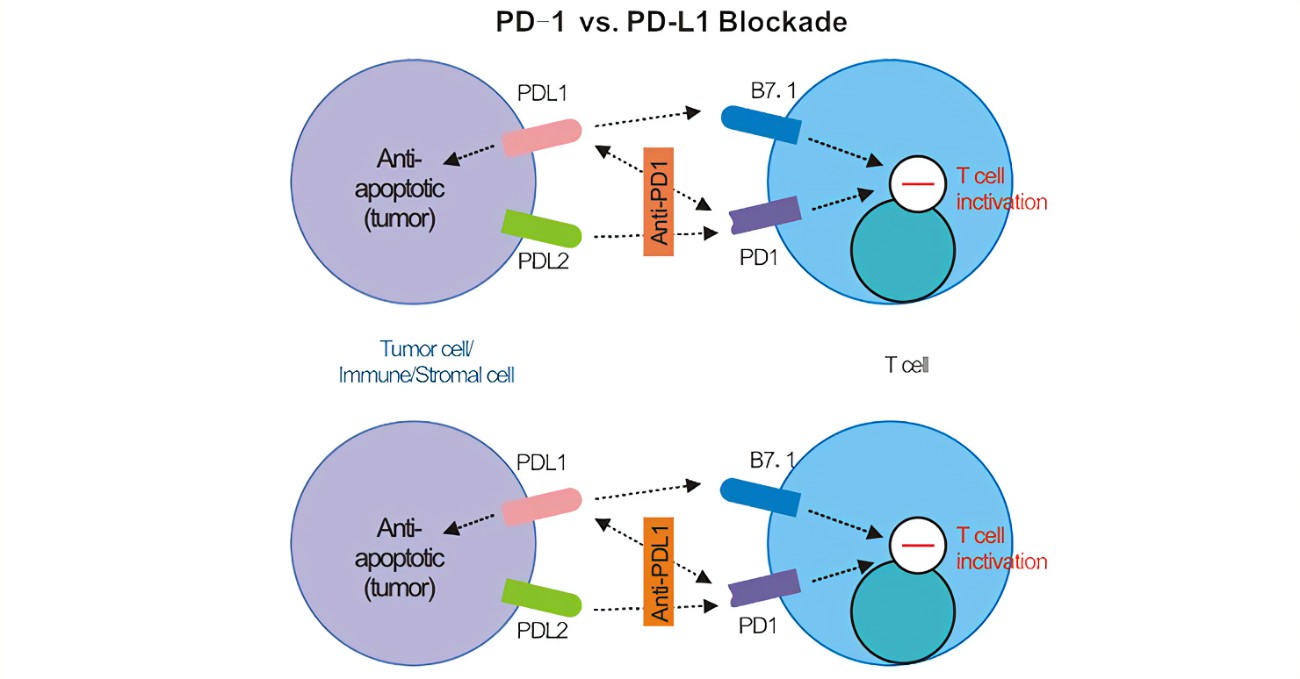
免疫检查点
免疫检查点可调节人体免疫以避免正常的组织损伤。CTLA-4和PD-1的抗体药物分别获批并投入使用,开启了靶向免疫检查点治疗抗体药物时代。PD1与其配体PDL1的结合限制了T细胞的活性,从而防止了过度刺激,维持了对自身抗原的免疫耐受。
阻断PD-1/PD-L1信号通路可使癌细胞死亡,但该疗法存在缺陷,大部分患者无明显疗效。目前,通过免疫骆驼筛选获得靶向PD-L1和CTLA-4的纳米抗体KN035和KN044,从而构建能够同时结合PD-L1和CTLA-4的双特异性纳米抗体。
补体系统介导的肿瘤免疫
补体系统能够清除病原体和受损的宿主细胞。然而,只有部分治疗性抗体能够诱导补体依赖性细胞毒性,需要寻找增强补体激活的新策略。补体系统与肿瘤的免疫逃逸密切相关,主要包括补体固有成分C3分子和C1q,补体活化产物C3a和C5a,及补体调节蛋白H因子和mCRPs。
靶向肿瘤的治疗性抗体
肿瘤靶向治疗需识别肿瘤细胞与常规细胞的不同,设计适合的分子药物,能否特异性靶向肿瘤细胞是其关键,因此靶区域的准确定位是关键。双特异性纳米抗体的分子量小、穿透性强的特点,为癌症靶向治疗提供了新的研究思路。
人类表皮生长因子受体2(human epidermal growth factor receptor-2, HER2)是一种酪氨酸激酶受体,在乳腺癌中过表达。目前,HER2靶向治疗是对HER2阳性肿瘤的一个重要治疗手段。有研究学者对HER2上不同表位的单特异性VHH和双特异性VHH进行比较,表明双特异性VHH具有更高的亲和力,并设计出靶向HER2并经人源化改造的双表位纳米抗体,并通过细胞杀伤性试验,证明了该抗体对HER2阳性细胞具有良好的杀伤效果。
参考文献
YUAN Bo,WANG Jie-wen,KANG Guang-bo,HUANG He. Research Progress and Application of Bispecific Nanobody. China Biotechnology, 2021, 41(2/3): 78-88.