近日《New England Journal of Medicine
》(IF=176
)在线发表题为“Lecanemab in Early Alzheimer’s Disease”的研究论文,该研究通过一项3期试验(Clarity AD)
来验证lecanemab在早期阿尔茨海默病
志愿者中的安全性和有效性。
阿尔茨海默病俗称老年痴呆症,目前全世界尚未发现可用于治愈该病的药物或治疗手段,诸多关于AD
患者的治疗研究主要集中于如何借助药物改善临床症状。已有一些研究表明,β-淀粉样蛋白 (Aβ)的积累可能
加速阿尔茨海默病的病理过程,淀粉样蛋白的去除可以减缓疾病的进展。
Lecanemab
是一种具有高亲和力的人源化单克隆抗体,可以选择性中和并清除导致阿尔茨海默病神经病变的可溶且有毒性的β-淀粉样蛋白(Aβ)聚集体。因此,lecanemab可能对AD病理过程产生积极影响并减缓疾病发展进程。
在此前对早期阿尔茨海默病患者进行的2b期临床研究
中,人源化单抗Lecanemab表现出了一定的治疗潜力
,并且研究表明lecanemab对淀粉样蛋白的清除依赖于剂量和时间,并且蛋白斑块的减少与认知测试评分改善存在正相关
,实验人员由此确定了Clarity AD试验的方案
。
Clarity AD是一项
为期18
个月、全球、双盲、安慰剂对照的的验证性III期研究,受试者
(志愿者)为1795名
年龄在50至90岁的早期AD患者。
志愿者按1:1的比例随机接受安慰剂或
人源化单抗lecanemab,治疗组每两周给予10mg / kg lecanemab。
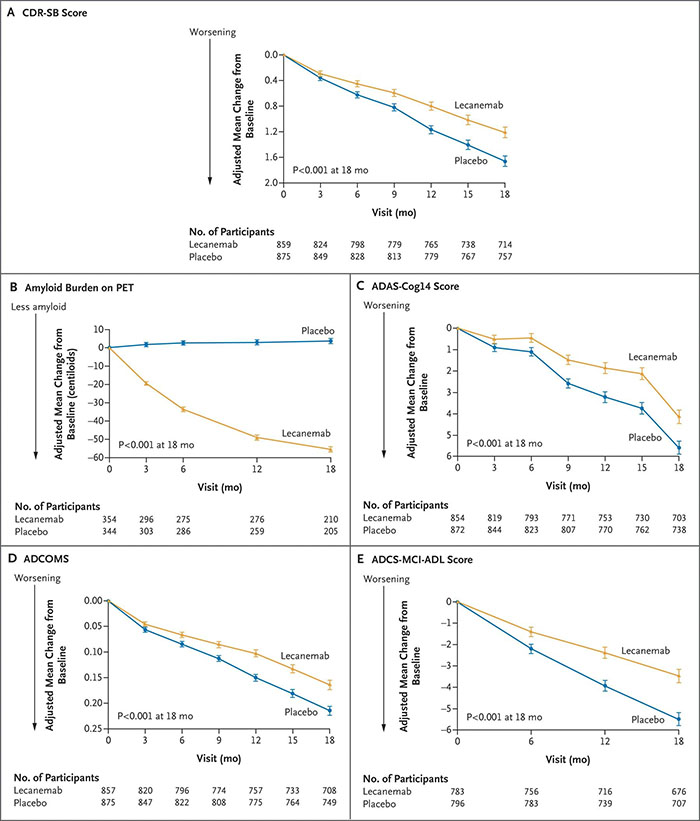
Clarity AD研究主要终点
是18
个月时志愿者临床痴呆评分总和(CDR-SB
)。关键的次要终点是PET上淀粉样蛋白负担的变化,AD评定量表认知部分(ADAS-cog14)、AD综合评分(ADCOMS)和AD协作研究-轻度认知功能障碍者日常生活能力量表(ADCS-ADL-MCI)
。
主要和关键的次要终点(图源自 New England Journal of Medicine )
该研究最终报告了1795名
志愿者的实验数据,其中898人接受
人源化单抗lecanemab
的治疗, 897人接受安慰剂。
在这项试验中,两组志愿者基线平均CDR-SB评分约为3.2
,研究人员对12
个月综合评分变化的分析显示,人源化单抗lecanemab与安慰剂之间差异
不大;对18
个月时,治疗组相对安慰剂组临床痴呆评分总和量表(CDR-SB)评分下降减缓了27%
,其他次要终点指标均有改善。
该Clarity AD
研究成果于2022年11月29日在阿尔茨海默氏症大会临床试验(CTAD)上
进行展示并在线发表于《New England Journal of Medicine
》期刊。
总之,这项研究表明了18个月时,
人源化单抗Lecanemab降低了早期阿尔茨海默病的淀粉样蛋白标记物,与安慰剂相比,认知和功能指标的下降程度略有降低
。但实验中概率出现症状性脑肿胀的不良事件,还需要后续需要更长的试验来确定验证lecanemab在早期阿尔茨海默病中的有效性和安全性。
原文链接:
Lecanemab in Early Alzheimer’s Disease | NEJM